PazoDoble
Gabe von Pazopanib im Gegensatz zu Pazopanib in Kombination mit Gemcitabin in Patientinnen mit wiedergekehrtem oder metastasierten Gebärmuttertumor – eine multizentrische, randomisierte Phase II Studie
Was wird in dieser Studie untersucht?
Pazopanib im Gegensatz zu Pazopanib in Kombination mit Gemcitabin in Patientinnen mit rezidivierten oder metastasierten uterinen Leiomyosarkomen oder uterinen Karzinosarkomen.
Es handelt sich um eine randomisierte, zweiarmige, Phase II Studie, in der die Wirksamkeit und Sicherheit Pazopanib im Gegensatz zu Pazopanib in Kombination mit Gemcitabin bei Patientinnen mit einem rezidivierenden (wiederauftretenden) Gebärmuttertumor untersucht wird.
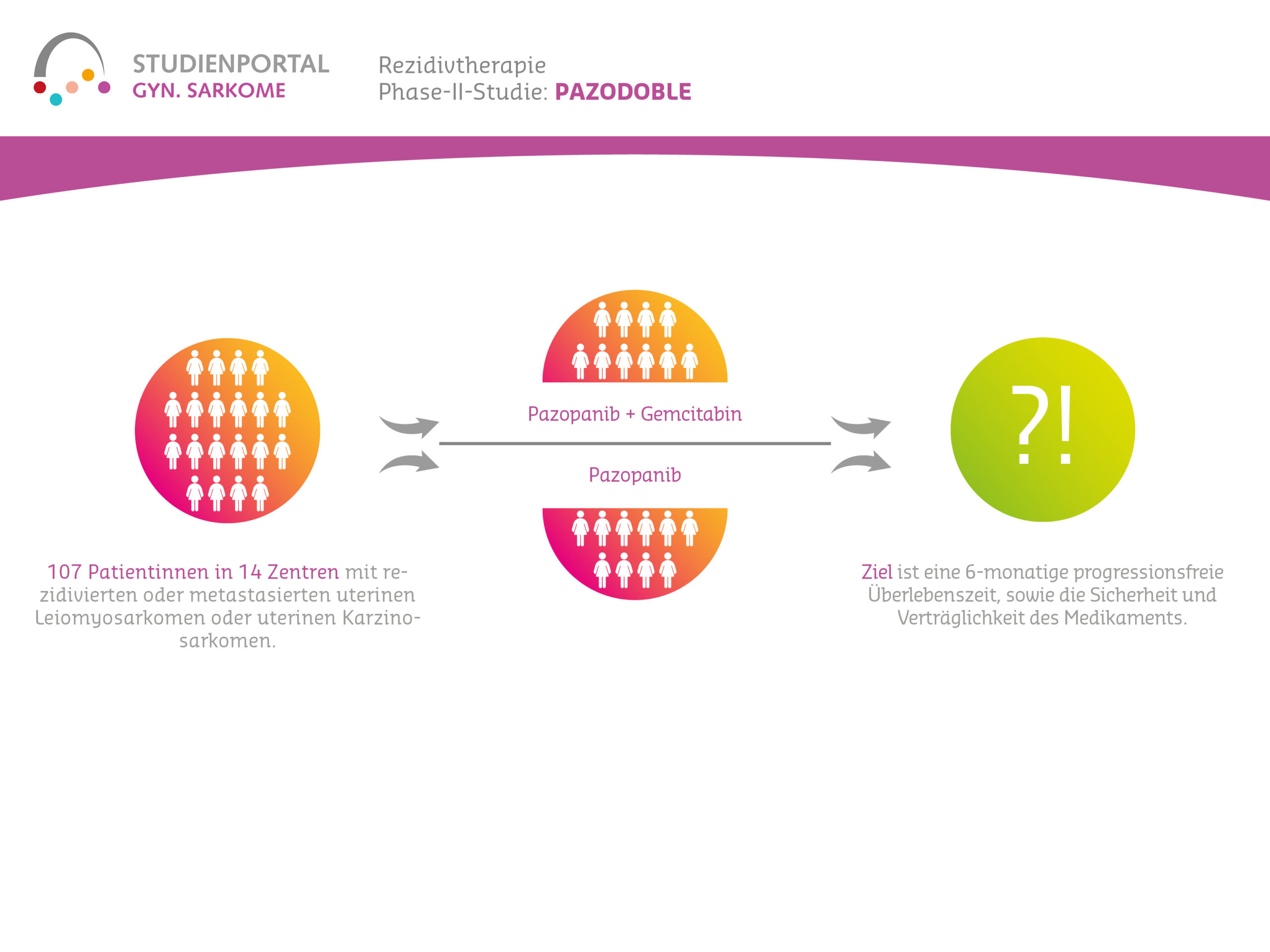
Der Behandlungsarm A mit nur Pazopanib gilt als Kontrollarm, um zu überprüfen, ob Behandlungsarm B, also die Therapie mit dem zusätzlichen Wirkstoff Gemcitabin, diesem überlegen ist.
Was ist das Ziel der Studie?
Diese Studie soll die Wirksamkeit von Pazopanib im Vergleich zur Kombination aus Pazopanib und Gemcitabin untersuchen.
Dabei sind die Hauptzielkriterien eine 6-monatige progressionsfreie Überlebenszeit, also die Zeitspanne vom Beginn der Studie bis zum Fortschreiten der Erkrankung sowie die Sicherheit und Verträglichkeit des Medikaments.
Wie ist der Ablauf der Studie?
Die Studie wird in etwa 14 Zentren randomisiert an 107 Patientinnen durchgeführt. Es handelt sich um eine klinische Prüfung, die über eine Dauer von etwa fünf Jahren ab Einschluss der ersten Patientin durchgeführt werden soll. Randomisiert wird 50:50.
Arm A: Pazopanib 800 mg oral 1x täglich plus Gemcitabin 1000 mg/m² i.v. über 30 min Tag 1 und Tag 8 q3w oder
Arm B: Pazopanib 800 mg oral 1x täglich.
Gibt es Risiken?
Über mögliche Risiken bzw. Nebenwirkungen, die mit der Teilnahme verbunden sind, werden Sie im Rahmen eines Aufklärungsgesprächs informiert.
Teilnahmevoraussetzungen:
An dieser Studie können Frauen im Alter ab 18 Jahren teilnehmen.
Patientinnen dürfen nur in die Studie eingebracht werden, wenn sie ALLE Kriterien erfüllen
- Schriftliche Einwilligungserklärung
- Histologisch oder zytologisch gesichertes uterines Leiomyosarkom oder uterines Karzinosarkom
- Adäquate Organfunktion nach vorgegeben Definitionen
Darüber hinaus gibt es zahlreiche weitere Kriterien, die für eine Teilnahme an der Studie erfüllt sein müssen. Interessierte Patientinnen sollten mit einem Prüfarzt/-ärztin an einem Studienzentrum sprechen, der/die prüfen kann, ob sie für diese Studie in Frage kommen.